

氧化应激与脂肪酸氧化的互作网络
1. 线粒体:代谢与氧化的交汇枢纽
线粒体作为细胞能量代谢的核心细胞器,是脂肪酸β-氧化的主要场所,同时也是活性氧(ROS) 的关键产生源。在生理条件下,线粒体通过氧化磷酸化(OXPHOS)高效产生ATP,同时维持ROS的动态平衡。然而,在代谢应激状态下,这一精细平衡会被打破。当肝脏脂质超负荷时,线粒体电子传递链(ETC)功能发生适应性改变,主要表现为细胞色素C氧化酶上游ETC组件的功能下调,同时维持甚至增强线粒体脂肪酸氧化能力。这种看似矛盾的适应机制导致ETC内部电子泄漏增加,显著刺激超氧阴离子(O₂•⁻)和过氧化氢(H₂O₂)的过量产生。
值得注意的是,非ETC来源的ROS在代谢性疾病中可能贡献更大。脂肪酸β-氧化过程本身可成为重要ROS来源,特别是在肝细胞中过量脂肪酸涌入时。当游离脂肪酸(FFA)浓度超过线粒体β氧化能力,部分FFA会分流至过氧化物酶体和内质网进行代谢,这些场所的氧化酶类(如XO、NOX)同样产生大量ROS。临床研究显示,在非酒精性脂肪性肝病(NAFLD)患者肝脏中,线粒体ROS生成增加与抗氧化酶活性下降并存,形成恶性循环。
线粒体通过持续的分裂-融合动力学维持其功能完整性。分裂主要由Drp1-Fis1/Mff复合体介导,而融合则依赖Mfn1/2和Opa1蛋白。在氧化应激条件下,Drp1过度激活导致线粒体碎片化,表现为点状、分散的形态。这种碎片化在阿尔茨海默病(AD)患者大脑中尤为显著,β-淀粉样蛋白(Aβ)与Drp1共定位,加剧神经元损伤。相反,在糖尿病视网膜病变模型中,Opa1缺失会激活Bax促凋亡通路,导致血管内皮细胞功能障碍。
2. 转录调控网络与代谢重编程
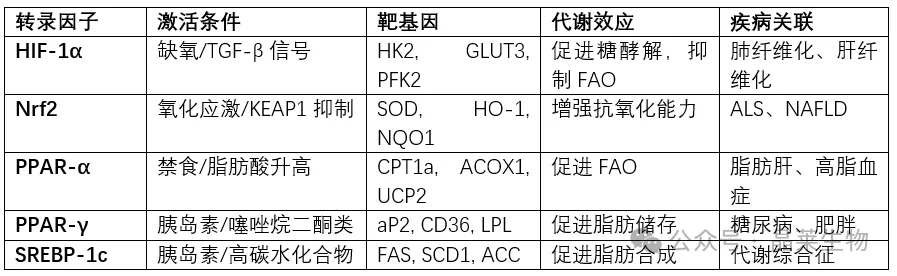
氧化应激通过多种转录因子网络调控脂肪酸代谢酶的表达,形成复杂的代谢重编程。其中,缺氧诱导因子-1α(HIF-1α) 在代谢转换中发挥核心作用。在二氧化硅诱导的肺纤维化模型中,TGF-β1通过抑制HIF-1α泛素化,在常氧条件下异常稳定其蛋白水平。活化的HIF-1α上调己糖激酶2(HK2)、葡萄糖转运蛋白3(GLUT3)等糖酵解基因,同时抑制肉碱棕榈酰转移酶1a(CPT1a)和PPAR-γ等脂肪酸氧化关键基因,促使细胞从脂肪酸氧化向糖酵解转换。
核因子E2相关因子2(Nrf2) 作为抗氧化反应的主调控因子,在氧化应激条件下通过创新机制被激活。最新研究发现,Nrf2蛋白翻译在氧化应激下通过La自身抗原介导的机制增强,迅速提升细胞抗氧化能力。在C9orf72相关的肌萎缩侧索硬化症(ALS)模型中,激活KEAP1/Nrf2通路可有效抑制线粒体功能障碍和氧化应激,显著改善运动表型。这一发现为神经退行性疾病提供了新的治疗思路。
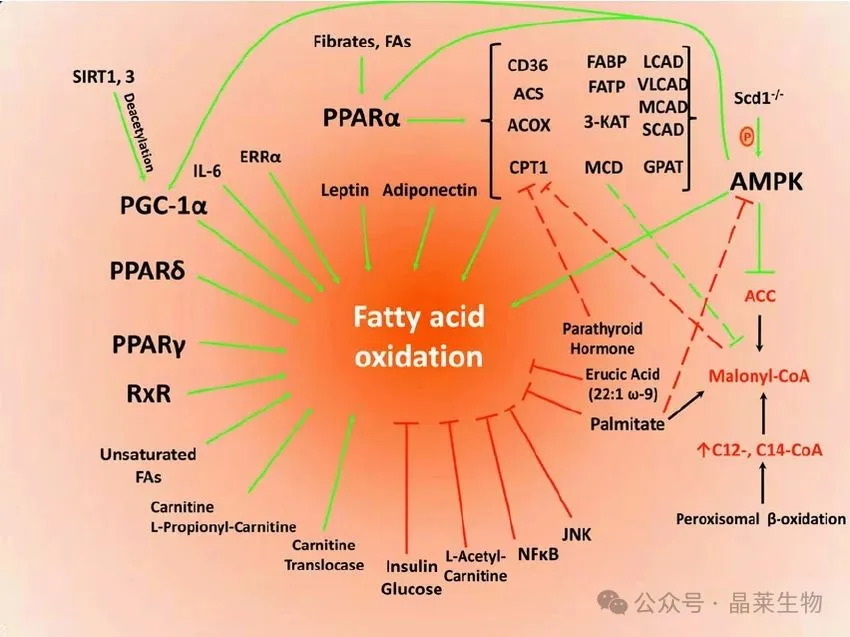
PPAR家族是脂肪酸氧化代谢的关键调控者。PPAR-α主要在肝脏表达,激活后促进脂肪酸β氧化相关基因转录;而PPAR-γ则在脂肪组织中高表达,参与脂肪细胞分化和脂质储存。在NAFLD进展中,PPAR-γ表达下降导致脂肪组织脂质储存能力减弱,促使更多脂肪酸流向肝脏,加剧肝细胞脂质堆积和氧化应激。这一发现解释了为何PPAR-γ激动剂(如吡格列酮)能有效改善肝脏胰岛素敏感性和脂肪变性。
表1:氧化应激与脂肪酸代谢的关键转录调控因子
3. 脂质过氧化:分子效应与信号传导
多不饱和脂肪酸(PUFA)因含有多个双键,极易受到ROS攻击而发生脂质过氧化,产生多种具有生物活性的醛类物质,如丙二醛(MDA) 和4-羟基壬烯醛(4-HNE)。这些活性醛具有高度亲电性,可与蛋白质的巯基(-SH)或氨基(-NH₂)形成共价加合物,改变蛋白质功能。在代谢综合征状态下,4-HNE通过激活NAD(P)H氧化酶加剧血管氧化应激,促进动脉粥样硬化斑块形成。研究显示,低密度脂蛋白(LDL)中的氧化磷脂酰胆碱(oxPC)是动脉粥样硬化的独立风险因子。
脂质过氧化产物通过调节关键信号通路影响细胞功能。在血管平滑肌细胞中,自由基处理导致cAMP浓度显著降低,而维生素E预处理可拮抗这一效应,表明氧化应激干扰G蛋白偶联受体(GPCR)信号传导。在肝脏中,4-HNE通过修饰线粒体膜蛋白,增加线粒体膜通透性,促进细胞色素C释放,启动凋亡程序,这一机制在非酒精性脂肪性肝炎(NASH)向肝纤维化进展中发挥关键作用。
细胞通过形成脂滴(LDs) 防御脂质过氧化损伤。在氧化应激条件下,脂多糖结合蛋白(LBP) 表达升高,其C端疏水结构域可捕获脂质并将其转运至脂滴中,隔离易被氧化的不饱和甘油三酯(UFA-TG)。研究发现,LBP通过过氧化物酶4(Prdx4) 感知细胞氧化还原状态,调节脂质穿梭过程。这一防御机制在肥胖和衰老过程中被长期激活,但持续上调可能导致胰岛素抵抗。
研究方法与干预策略
1. 氧化损伤的精准检测技术
脂质过氧化产物的精准检测是评估氧化应激程度的关键。高效液相色谱-质谱联用技术(HPLC-MS) 已成为检测羟基和氢过氧基PUFA区域异构体的金标准。通过优化色谱分离条件和质谱参数,研究者可同时定量数十种氧化脂质分子。在临床研究中,血浆中特定氧化磷脂如POVPC(1-palmitoyl-2-(5-oxovaleroyl)-sn-glycero-3-phosphocholine)的水平与动脉粥样硬化斑块稳定性显著相关。
电子顺磁共振(EPR) 与自旋捕捉技术结合,可直接检测短寿命的脂质自由基。常用自旋捕捉剂如PBN(α-phenyl-N-tert-butylnitrone)和DMPO(5,5-dimethyl-1-pyrroline N-oxide)可与脂质自由基形成稳定加合物,通过特征性EPR信号进行定性和定量分析。这一技术在评估抗氧化剂功效方面具有独特优势,如研究证实羟基酪醇及其代谢物高香草醇能显著降低H₂O₂诱导的肾小管上皮细胞中脂质自由基水平。
线粒体氧化应激的特异性检测技术近年取得显著进展。线粒体靶向的氧化还原敏感荧光探针(如MitoSOX Red)可特异性检测线粒体超氧阴离子。在C9orf72-ALS果蝇模型中,MitoSOX染色显示大脑中线粒体ROS水平显著升高,且与运动功能障碍程度呈正相关。此外,线粒体谷胱甘肽氧化还原电位报告系统(mito-roGFP2-Grx1)可实时监测线粒体基质内GSH/GSSG比值,为氧化还原稳态提供动态评估。
2. 靶向干预策略
天然抗氧化剂在调节氧化应激与脂肪酸氧化平衡中展现多效性。研究表明,ω-3多不饱和脂肪酸(特别是DHA和EPA)通过多重机制发挥保护作用:竞争性降低促炎性ω-6脂肪酸代谢;激活PPAR-α促进脂肪酸氧化;直接清除脂质过氧自由基。临床试验证实,ω-3脂肪酸联合维生素E补充可显著增强LDL抗氧化能力,延缓动脉粥样硬化进展。
线粒体靶向抗氧化剂代表新一代抗氧化策略。MitoQ通过将泛醌连接到三苯基膦阳离子上,特异性靶向线粒体基质,有效减轻缺血再灌注损伤。其纳米制剂(nMitoQ)更可改善胎盘血管生成,拓展临床应用前景。另一重要突破是烟酰胺核苷(NR) 的应用,其作为NAD⁺前体,通过激活SIRT3恢复线粒体功能。老年个体口服NR后,肌肉NAD⁺代谢组呈现年轻化特征,线粒体呼吸能力显著改善。
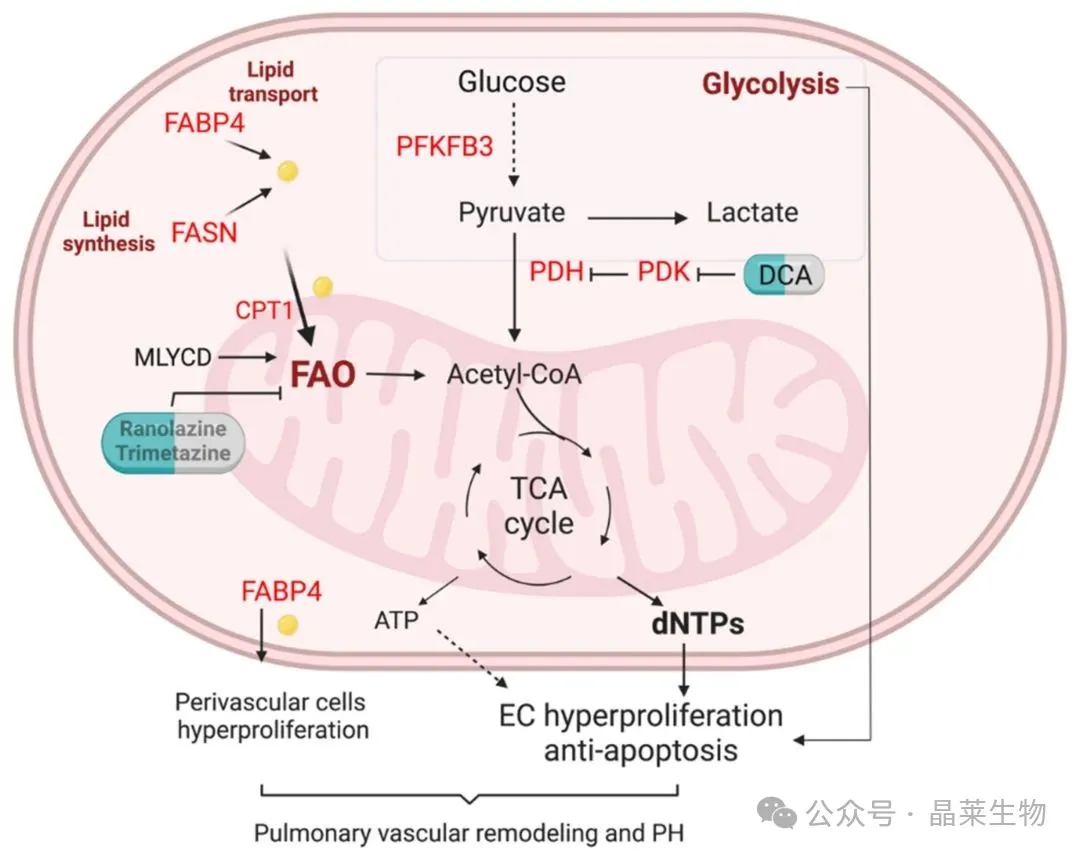
代谢重编程干预通过调控脂肪酸氧化与糖酵解平衡发挥治疗作用。在二氧化硅诱导的肺纤维化模型中,FAO激活剂吡格列酮(PPAR-γ激动剂)可促进肌成纤维细胞内胶原降解,表现为溶酶体与胶原的共定位增加和外源性DQ-胶原的内吞降解增强。而糖酵解抑制剂3PO则通过抑制PFKFB3(6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3),减少ECM合成关键修饰酶LOX的活性,降低胶原交联度。值得注意的是,两种干预对ECM的作用路径不同:3PO主要抑制胶原合成,而吡格列酮促进胶原降解。
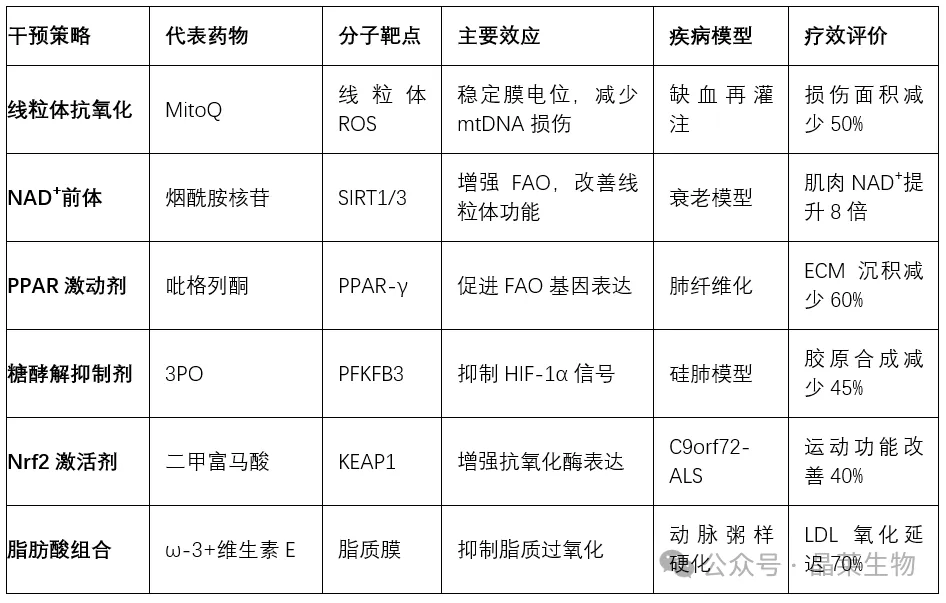
表2:靶向氧化应激与脂肪酸氧化的临床前药物评价
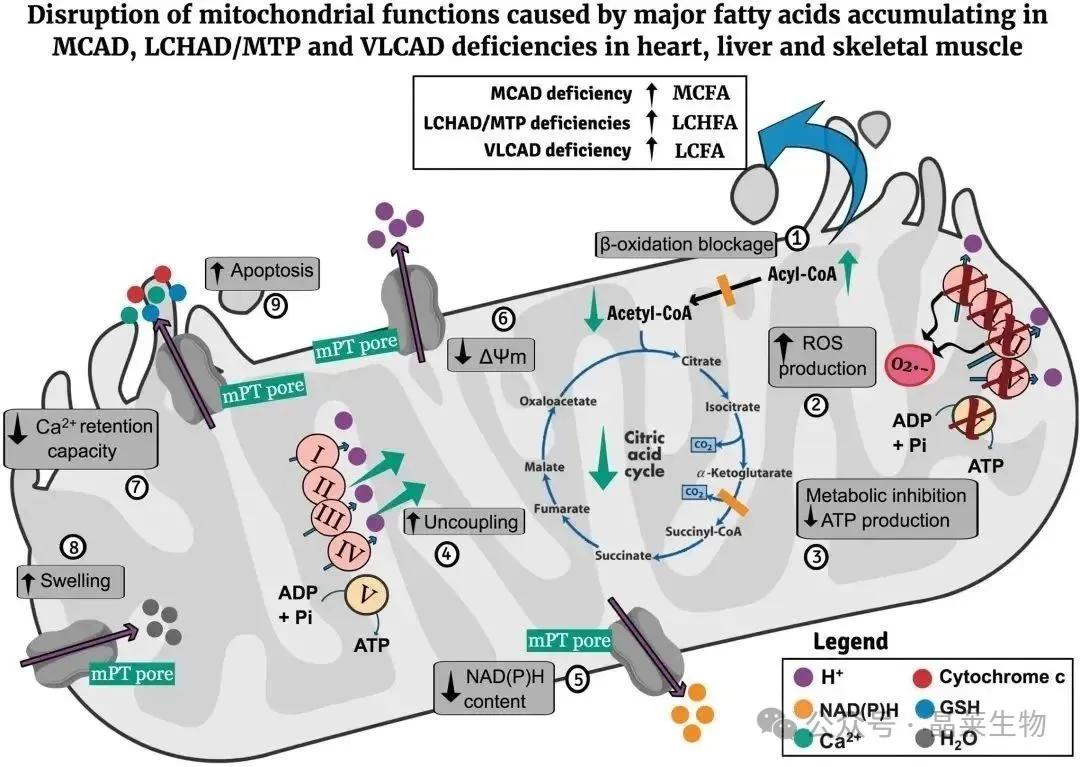
疾病中的病理机制
1. 代谢性肝病:脂毒性、氧化应激与炎症的恶性循环
非酒精性脂肪性肝病(NAFLD) 已成为全球最常见的慢性肝病,全球患病率约25%,在中国高达29.2%。其发病机制遵循 “多重打击”假说:初始打击为胰岛素抵抗(IR)导致的肝脏脂肪变性;二次打击为氧化应激引发的炎症反应和肝细胞损伤。在NAFLD进展中,线粒体功能通过下调电子传递链(ETC)组件同时维持脂肪酸氧化能力来适应脂质超负荷,这种代偿机制导致细胞色素C氧化酶上游ETC组件内ROS过度产生。
脂滴稳态失衡是NAFLD向NASH转变的关键环节。正常情况下,脂滴通过隔离不饱和甘油三酯(UFA-TG)防止其过氧化。在持续氧化应激下,脂多糖结合蛋白(LBP) 表达上调,其C端疏水结构域捕获脂质并转运至脂滴。然而,长期刺激导致LBP持续高表达,反而促进胰岛素抵抗和脂肪变性。这一发现解释了为何单纯抗氧化治疗在晚期NAFLD效果有限,需同时调节脂滴动态平衡。
线粒体自噬缺陷加剧肝细胞损伤。受损线粒体通过PINK1/Parkin或BNIP3/NIX通路被选择性清除。在NAFLD患者肝脏中,PINK1表达显著降低,导致功能失调线粒体积累,ROS持续产生。实验研究表明,纳米氧化锌(ZnO-NPs)可通过HIF-1α/BNIP3/LC3B轴激活线粒体自噬,减轻高脂饮食诱导的肝脏脂肪变性和炎症反应。
2. 心血管与神经退行性疾病
在心血管系统中,氧化应激与动脉粥样硬化的病理过程密切相关。低密度脂蛋白(LDL)中的不饱和脂肪酸在血管内皮细胞处易发生脂质过氧化,形成氧化型LDL(ox-LDL)。ox-LDL通过清道夫受体被巨噬细胞吞噬,形成泡沫细胞,构成动脉粥样硬化斑块的核心。研究发现,氟伐他汀不仅能降低胆固醇,还能直接保护LDL免受铜离子诱导的氧化,这一抗氧化特性独立于其降脂作用。
高血压的发生发展与血管氧化应激密切相关。高血压大鼠主动脉对H₂O₂的收缩反应显著增强,表明氧化应激加剧血管张力调节障碍。机制研究发现,血管紧张素Ⅱ通过激活NADPH氧化酶(NOX),增加血管O₂•⁻产生,抑制一氧化氮(NO)信号通路,导致血管内皮功能障碍和血管平滑肌细胞异常收缩。
神经退行性疾病中,线粒体功能障碍是共同病理特征。在C9orf72相关的ALS/FTD模型中,果蝇神经细胞表现出线粒体形态异常、氧化应激加剧和线粒体自噬缺陷,这些变化与进行性运动功能障碍密切相关。机制研究表明,激活KEAP1/Nrf2通路可显著抑制线粒体ROS产生,改善运动表型。在帕金森病(PD)模型中,VSIG4通过激活JAK2/STAT3通路,抑制氧化应激和线粒体功能障碍,减轻多巴胺能神经元损伤。
3. 纤维化疾病:代谢重编程的核心作用
肺纤维化的特征是肌成纤维细胞异常增殖和细胞外基质(ECM)过度沉积。南京医科大学倪春辉团队研究发现,二氧化硅诱导的肺纤维化中,肌成纤维细胞经历显著的代谢重编程:糖酵解增强而脂肪酸氧化(FAO)减弱。代谢组学分析显示,肺纤维化小鼠组织中糖酵解中间产物(3-磷酸甘油酸、葡萄糖-6-磷酸)显著增加,而FAO相关代谢物(3-羟基丁酸、L-肉碱)水平降低。这种代谢转换由HIF-1α主导,通过上调糖酵解基因(HK2、GLUT3)和抑制FAO基因(CPT1a、PPAR-γ)实现。
肝纤维化中的核心机制是肝星状细胞(HSC) 活化。复旦大学团队研究发现,HIF-1α/LTBP2轴通过ERK通路与LOXL1相互作用,激活HSC并促进上皮-间质转化(EMT)。在CCl₄诱导的小鼠肝纤维化模型中,LTBP2表达显著升高,而靶向抑制LTBP2可减轻纤维化程度。机制上,TGF-β1通过抑制HIF-1α泛素化,在常氧条件下稳定其蛋白水平,进而转录激活LTBP2表达,形成促纤维化正反馈。
肾纤维化中的关键调控轴是HIF-1α/miR-145b/Angpt2。在单侧肾缺血再灌注(uIR)模型中,HIF-1α诱导miR-145b表达,后者通过靶向抑制Angpt2,减轻肾小管损伤和间质纤维化。当使用锁核酸(LNA)抑制miR-145b时,小鼠肾功能恶化,纤维化程度加剧,表明该通路在肾脏保护中的关键作用。
氧治疗前景与挑战
1. 线粒体靶向治疗
线粒体靶向药物代表下一代抗氧化治疗方向。MitoQ作为首个进入临床试验的线粒体靶向抗氧化剂(已完成II期),在代谢性疾病中展现潜力。其创新纳米制剂(nMitoQ)可穿透胎盘屏障,改善妊娠并发症中的血管生成障碍。线粒体移植技术近年取得突破,在心脏骤停模型中,将健康线粒体递送至心肌细胞使存活率从55%提升至91%,为急性缺血损伤提供新思路。
亚精胺通过增强Parkin介导的线粒体自噬发挥抗衰老作用。在卵巢衰老模型中,亚精胺显著提高卵母细胞活力,机制上通过促进线粒体融合蛋白Opa1表达,改善线粒体网络功能。另一创新策略是光生物调节(PBM) ,利用650nm激光激活细胞色素C氧化酶,减少IL-6等炎症因子,在类风湿关节炎模型中效果显著。
2. 代谢干预策略
基于代谢重编程的干预策略在纤维化疾病中前景广阔。HIF-1α抑制剂通过双重机制抗纤维化:抑制糖酵解同时促进FAO。在矽肺模型中,靶向HIF-1α的PX-478联合吡格列酮使纤维化面积减少75%,显著优于单药治疗。AMPK激活剂(如二甲双胍、AICAR)通过磷酸化抑制ACC,降低丙二酰CoA水平,解除其对CPT1a的抑制,促进脂肪酸进入线粒体氧化37。
时间限制性进食(TRF)通过生物钟重编程改善代谢。研究表明,将摄食窗口限制在每天6-8小时可诱导:1) 肝脏分子钟基因Bmal1振幅增强;2) SIRT1/PGC-1α通路激活;3) 空腹期酮体生成增加40%。在NAFLD患者中,12周TRF干预使肝脏脂肪含量降低21%,氧化应激标志物MDA减少35%。
3. 挑战与展望
尽管靶向氧化应激与脂肪酸氧化的治疗策略前景广阔,仍面临多重挑战:1) 组织特异性差异:如Drp1抑制剂在神经保护同时可能引发心脏毒性;2) 代偿机制激活:抑制糖酵解可能导致脂肪酸氧化代偿性增强,反之亦然;3) 血脑屏障穿透:纳米载体递送效率不足,影响神经疾病治疗效果。
未来研究将聚焦:1) 个性化方案:基于mtDNA突变谱和代谢组特征制定精准干预策略;2) 细胞器互作网络:解析线粒体-内质网-脂滴接触在氧化应激中的动态调控;3) 基因编辑技术:利用CRISPR/Cas9靶向矫正致病性mtDNA突变,从根源恢复代谢稳态。
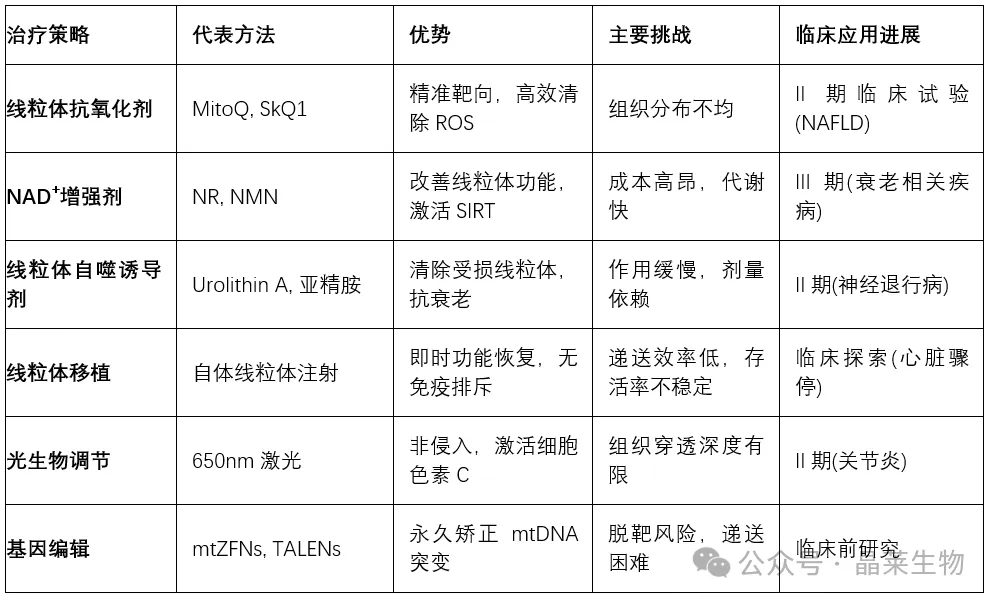
表3:线粒体靶向治疗的前景与挑战
总之,氧化应激与脂肪酸氧化失衡构成多种代谢性、纤维化和神经退行性疾病的共同病理基础。通过多组学技术解析个体化代谢特征,开发时空精准的靶向递送系统,将推动从“抗氧化”向“代谢重编程”的治疗范式转变,为重大慢性病防治提供新机遇。
关于晶莱
